3차원 생체조직 칩 기반 신약개발 플랫폼 기술
목차
1. 3차원 세포배양의 필요성과 현황
2. 스페로이드/오가노이드
3. 바이오프린팅과 바이오잉크
4. 오간온어칩(Organ-On-a chip)
5. 멀티 오간온어칩
6. 결론 및 제언
1. 3차원 세포배양의 필요성과 현황
세포를 3차원으로 배양해야 하는 이유
세포주나 환자유래세포, 성체, 배아 및 유도만능 줄기세포와 같은 줄기세포를 이용하여 질환을 모사하는 기존의 방법들은 배양 접시에 2차원으로 배양한 세포를 이용하므로 실제 환자 조직 내 세포들과는 다른 배양 환경에서 배양되며 세포와 세포간의 상호작용을 제한적인 수준으로만 재현할 수 있음. 이러한 방식으로 특정 약물의 효능이나 부작용을 평가하고, 특정 질병의 발병과 치료기전을 규명할 경우 제한적인 수준의 형질과 단편적인 기능성 결핍만 확인 가능함.
- 2차원으로 배양된 세포는 세포 고유의 기능성이 배양과정 중 저하·소실되며 이로 인해 부정확한 평가결과가 도출될 수 있음. 따라서 질환모사연구 및 신약개발의 정확성과 신뢰성을 확보하기 위해 실제 장기의 구조적, 생리학적, 환경적 특성을 3차원으로 반영하여 모사할 수 있는 3차원적 배양시스템의 필요성이 증가하고 있음.
세포를 미세환경 하에서 배양해야 하는 이유

- 과거 백인에 비해 흑인 수영선수가 드문 이유에 대한 사회학자들의 토론이 활발히 이루어진 적이 있는데, 당시 많은 사회학자들은 흑인은 근육의 밀도가 높아서 수영에 적합하지 않다는 이론을 제시하였으나 이러한 이론들은 이후에 제시된 환경적인 관점, 즉 흑인의 일반적인 생활환경과 교육환경으로 인해 미국에서 성장하는 흑인들은 수영보다는 농구나 야구 같은 운동에 더 익숙하다는 관점에 의해 극복된 바 있음.
- 최근 생물학이나 의학 분야의 경우 세포 자체도 중요하지만 특정 세포가 처한 환경에 대한 관심이 많아지는 중인데 줄기세포의 분화, 암의 전이, 특정 질병의 발병 등의 문제에서 세포나 장기 자체를 분석하는 본질적인 관점에 더하여 그 세포나 장기 주변의 다른 세포 다른 장기와의 상호작용을 분석하는 관점의 필요성이 점차 강화되고 있음. 따라서 세포가 자리 잡은 다양한 미세환경들을 3차원으로 구현하는 기술은 생물학 연구와 의학 연구에 새로운 혁신을 불러일으키는 중이며 특히 특정 질병이나 장기를 재현하는 과정에서 고유의 미세환경하에 자리잡은 타겟 세포를 분석하는 기술과, 미세환경 자체를 분석하는 기술이 모두 놀라운 속도로 발전하는 중임.
3차원 세포배양의 필요성
3차원 세포배양의 역사는 1993년으로 거슬러 올라가는데, 당시 미국 MIT Langer 교수와 Harvard 의대 Vacanti 교수가 손상된 장기 또는 조직을 대체하기 위하여 생분해성 고분자 스캐폴드 내 장기 또는 조직을 구성하는 세포를 체외 환경에서 3차원 배양한 후 생체 내 이식(implantation)을 한다는 ‘조직 공학 (Tissue Engineering)’ 개념을 Science지에 논문을 발표하며 이 용어가 널리 쓰이기 시작함.

이후 생체재료, 생물공학, 의과학을 포함한 다양한 분야에서 많은 연구자들이 지속적으로 연구 개발을 이어나갔으나 임상적으로 2006년이 되어서야 미국 Wake Forest 의대 Atala 교수의 주도로 방광 (bladder)을 이식하는데 성공함. 그러나 방광은 얇은 막으로 둘러싸인 주머니 형태의 비교적 단순한 장기라 첫 이식의 대상이 된 것이며 그만큼 조직 공학이 임상적 유효성을 나타내기에는 대단히 어렵다는 점을 반증함.
조직 공학의 성공에 있어서 가장 큰 어려움으로 대두된 것은 바로 ‘mm, cm 크기의 공학적 조직 구조체(engineered tissue construct)를 어떻게 괴사 없이 산소와 양분을 잘 공급하여 3차원 장기 배양을 이어나갈 것인가’로 최근 다양한 기술의 발전과 함께 차츰 해결되어 가고는 있으나 현재까지도 완벽히 해결되지는 못 하고 있음.
참고로 줄기세포 기술의 발전과 함께 조직 공학은 이후 재생 의학 (regenerative medicine)이라는 용어로 바뀌어 사용되고 있는 추세이며 3차원 세포배양은 스페로이드, 오가노이드, 조직칩, 바이오프린팅과 같은 새로운 기술이 등장하면서 새로운 응용 분야를 개척하기 시작함.
창발성과 조절 가능성의 확대
창발(創發, emergence) 또는 떠오름 현상은 하위 계층에는 없는 특성이나 행동이 상위 계층에서 자발적으로 돌연히 출현하는 것을 말함. 3차원 세포배양을 위해 스페로이드나 오가노이드, 조직칩, 바이오프린팅 기술 등이 개발되어 왔는데 이 기술들은 모두 세포를 복잡하게 구성하여 하위 계층인 단일 세포들이 갖지 못한 새로운 특성들을 상위 계층, 즉 3차원 생체조직에서 발현되게 만드는 공통점이 있음.
창발성은 새로운 아이디어와 지식을 만들어 내지만 산업적인 입장에서는 예측과 조절이 불가능한 문제가 있기 때문에 세포/조직의 3차원 배양 기술은 보다 복잡한 구조를 만들어 창발성을 높이는 것도 필요하지만 반복적인 재현과 생산, 품질에 대한 조절이 가능하여 산업적으로 활용할 수 있도록 조절가능성(controllability)을 높이는 방향 즉 두 마리 토끼를 모두 잡는 방향으로 개발되어야 함.
공학적 조직 구조체에서 발전한 공학적 다중세포 생체시스템(multi-cellular engineered living system)이라는 정의는 기존에 따로따로 개발된 세포/조직의 3차원 세포배양 기술들을 묶을 수 있으며 이를 통해 단일한 비전을 갖춘 기술개발의 방향 제시가 가능함. 예를 들어 3차원 생체조직 칩이라는 것은 단순히 칩만을 의미하는 것이 아니라 다중세포 생체시스템을 구성하는 조직을 3차원으로 배양할 수 있는 다양한 형태의 공학적 기술을 의미하는데 이에 따라 정부의 지원은 만들어진 생체시스템의 창발성을 향상시켜 고도화된 기술적인 가능성을 확보함으로써 세계를 선도하는 새로운 혁신을 제시하는 것과 조절가능성을 향상시켜 높은 산업적 가치를 확보하는 것 두 가지 방향을 함께 이끌어갈 수 있어야 하며 최근 제안된 3차원 생체조직 칩 기반 신약개발 플랫폼 기술 개발 사업 역시 이러한 철학 하에서 기획되었음.

스페로이드/오가노이드 기술의 개요
스페로이드는 한 종류 혹은 여러 종류의 세포를 균일한 형태(일반적으로 구형)로 뭉친 세포 집합체를 말하며 오가노이드는 전능성줄기세포 또는 체내유래 성체줄기세포로부터 자가조직화를 유도하여 복잡한 3차원적 구조를 형성한 것을 의미함. 두 기술 모두 조직의 특성을 반영할 수 있으며 특히 줄기세포에서 자가조직화하는 오가노이드 기술은 조직의 고유한 구조를 매우 높은 수준으로 모사하면서 높은 창발성을 갖는 특징이 있음.

- 스페로이드/오가노이드 형태로 만들어진 3차원 생체조직은 환자 조직의 구조와 분자 생리학적 병변을 정밀하게 반영할 수 있는 차세대 질환모사 및 신약개발 플랫폼으로 주목받아 2015년 MIT에서 선정한 10대 미래유망기술에 선정된 바 있으며, 관련 분야의 산업규모도 국내 외 모두 꾸준하게 성장하고 있음.
- 최근에는 신경계(대뇌, 중뇌, 소뇌), 내분비계(췌장, 간, 대장), 비뇨기계(신장) 등의 장기들을 스페로이드/오가노이드를 통해 표준화하고 대량생산하는 기술들이 다양하게 개발 중이며, 이를 기반으로 각 장기별 독성 평가 모델을 구축하고, 감염이나 약물로 인한 장기의 염증 질환모사체를 개발하며 다양한 질병 관련 혹은 질병을 정확하게 타겟하는 약물의 유효성 평가모델과 독성 평가모델들이 구축되는 중임.
스페로이드/오가노이드 기술의 현황
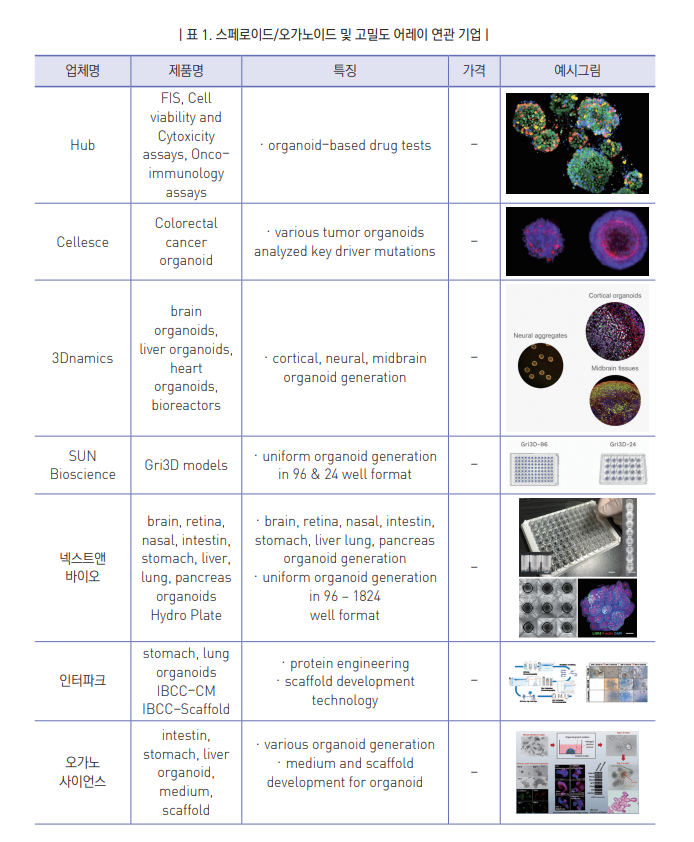
국내의 3차원 스페로이드/오가노이드 연구의 경우 2015년에 이미 약 1,000억원에 도달했으며, 현재 2020년 기준으로 약 4,000억원의 시장규모로 파악됨. 다양한 국내 기관에서 스페로이드/오가노이드 개발을 위한 투자 및 연구를 활발하게 진행하고 있으나 이에 기반한 약물 유효성 및 독성평가 시장은 제대로 형성되지 않았는데 최근 넥스트앤바이오, 오가노사이언스 등의 벤처기업들이 투자유치에 성공하였고 인터파크가 관련 분야에 투자를 시작하면서 국내 산업의 성장을 촉진하는 중임.
해외의 3차원 스페로이드/오가노이드의 해외 시장규모는 2015년 8,439억원, 2020년은 31,333억원으로 전망되며 큰 시장 규모와 높은 성장세를 바탕으로 연구개발이 활발히 진행 중으로 특히 암세포나 특정 조직의 오가노이드를 ORGANOGENIX, Cellesce, Epistem과 같은 기업에서 상용화 중이며, 국가에서는 이에 관련한 규제들을 신규 제정하는 중임.
스페로이드/오가노이드 배양체 연구에 더하여 이를 표준화시켜 대량 생산 분석할 수 있는 고밀도 어레이의 시장규모도 동반 성장하는 추세임.



3. 바이오프린팅과 바이오잉크
바이오프린팅 기술의 개요
바이오프린팅 기술은 기존의 3D프린팅 기술을 조직공학에 응용한 방법으로 세포를 생물 소재 혹은 천연 고분자와 함께 바이오잉크로 사용하여 원하는 형태로 조형하여 조직이나 장기를 제작하는 기술을 의미함.
고령화 사회가 지속함에 따라 장기 이식 수요가 증가하고 있지만 장기기증자 수의 부족으로 장기 이식 대기자의 수가 증가하고 있음.
- 보건복지부와 국립장기이식관리센터 등의 자료에 따르면 2019년 6월 기준으로 장기 기증 대기자는 38,977명으로 2015년 27,444명에 비해 증가하는 추세를 나타내지만 뇌사 장기기증자 수는 2015년 501명에서 2019년 6월 213명으로 감소하는 추세임.
바이오프린팅 기술은 위의 장기 이식 수요에 대한 문제를 해결할 수 있는 획기적인 기술로서 정밀도가 높은 수준으로 대량 생산이 가능할 수 있으며 환자 맞춤형 장기를 제작하여 기존의 이식 과정에서 발생할 수 있는 면역거부반응 등의 부작용 또한 해결할 수 있음.
이에 따라 Grand View Research, Inc.에서는 바이오프린팅 기술의 시장규모 및 연평균 성장률을 미국에서만 각각 약 1.16조 원, 19.5 % (2018년 기준)으로 추정하였으며 2026년까지 5조 원에 달할 것으로 추정함.
국내에는 T&R Biofab이 바이오프린팅 기술을 기반으로 하여 코스닥에 상장하였으며, 로킷 헬스케어가 바이오프린팅에 기반한 피부 등의 이식용 제품을 출시하면서 성장하고 있음.

3D 바이오프린팅은 복잡하고 다기능의 3D 생체 구조의 구현을 위해 생체모방, 자율적 자가조립, 미니 조직 블록을 활용한 주요 세 가지 접근방식이 제시되고 있음. (A. Atala et al. 2014, Nature Biotechnology)
바이오프린팅을 위한 바이오잉크는 성공적인 생체적합성, 생분해성, 충분한 기계적 물성, in vivo 조직 유사성 등 다양한 특성들을 최적화해야 함.
- 위의 조건들을 만족시키기 위한 다양한 천연 고분자 및 합성 고분자들이 바이오잉크의 원료로 사용됐으나 천연 고분자는 기계적 물성에 개선이 요구되며 합성고분자는 생체적합성 및 생분해성에 대해 보완이 필요함.

기술 개발 현황 및 동향
바이오프린팅 방식은 대표적으로 inkjet, micro-extrusion, laser-assisted printing으로 분류됨 (A. Atala et al. 2014, Nature Biotechnology).
- Inkjetbioprinting은 바이오잉크를 물방울 형태로 표면에 떨어뜨려 주는 방식으로 비교적 적은 비용으로 빠른 속도로 프린트할 수 있는 장점이 있으나 잉크가 액체상태로만 적용되어야 하는 단점을 가짐.
- Micro-extrusion bioprinting은 물리적 힘으로 잉크를 연속적으로 분출해주는 방식으로써 다량의 세포가 함유되어있는 잉크도 적용 가능하여 인공조직 및 장기를 제작하기 위해 더욱 적절한 시스템이지만 프린팅 후 세포의 생존율 및 기능성에 부정적 영향을 미칠 수 있음.
- Laser-assisted bioprinting은 Lift(Laser-induced forward transfer)를 사용한 프린팅 기법을 생체재료에 적용한 방식으로 레이저 펄스를 통해 바이오잉크를 흡수층에 가하여 패턴을 프린팅하는 방식으로 매우 정밀한 프린팅을 유도할 수 있으나 시간이 많이 소요되고 생산물에 금속 잔여물이 검출되는 단점이 존재함.
현재 바이오프린팅 기술 및 바이오잉크 모두 Organovo®, Allevi®, CELLINK®, Advanced Solutions® 등 다양한 회사에서 연구가 진행 중이며 관련 제품의 제작/판매가 진행되고 있음. (M. Heinrich et al. 2019, Small)
- 대표적으로 판매되고 있는 Organovo사의 NovaGen은 위, 간, 장 등의 조직을 프린팅할 수 있는 시스템/플랫폼이며 특히 프린트된 간 조직에 약물에 의한 간 섬유화(liver fibrosis) 모델링이 가능함을 보여줌. (L. norona et al. 2016, Society of Toxicology)
- Cyfuse biomedical사는 바이오프린팅을 이용해 미세한 바늘 모양의 구조체에 스페로이드를 쌓아 올려 혈관구조와 유사한 형태로 제작함.
- 3D Bioprinting Solutions사의 FABION은 여러 종류의 프린팅 방식을 모두 가능하게 하고 UV 장치가 함께 설치되어있어 UV를 이용하여 가교되는 하이드로젤의 정교한 프린팅 및 모델링이 가능함.
이전부터 바이오잉크는 poly(ethylene glycol), methacrylated-gelatin (GelMA) 등의 합성재료 및 콜라겐, 실크 등의 천연 고분자들이 사용되어 왔음. (M. Hospodiuk et al. 2017, Biotechnology Advances)
구조물의 형태를 잘 유기하기 위해서는 우수한 물성을 가진 바이오잉크가 필요하므로 이를 개선하기 위한 연구가 활발히 진행되고 있음.
- 특히, 주재료에 나노소재를(nano-silicate 등) 혼합함으로써 물성을 강화한 시도들이 있음. (J. Xavier et al. 2015, ACS nano; K. Zhu et al. 2017, Advanced Functional Materials)
- 그러나 주로 사용되는 단순 합성 및 천연 고분자만으로는 in vivo 조직과 유사한 환경을 모사하기에 한계가 있음.
실제 조직과 유사한 구조 및 구성성분을 가질 수 있도록 탈세포화를 거친 조직의 세포외기질을 바이오잉크로 활용함으로써 세포에 이상적인 미세환경을 제공할 수 있는 연구들이 활발히 진행되고 있음. (F. Pati et al. 2014, Nature Communications)
- 대표적으로, 탈세포화 근육 및 간 조직을 사용함으로써 기존의 콜라젠 기반 바이오잉크보다 안정적인 세포 생장률, 분화율 및 기능성을 유도할 수 있음을 확인하였음. (Y. Choi et al. 2016, Advanced Healthcare Materials; H. Lee et al. 2017, Biomacromolecules)
- 탈세포화 식도 조직으로 제작한 바이오잉크를 micro-extrusion 바이오프린팅 기법에 적용하여 다층으로 구성되어 있는 실제 식도 구조를 모사한 논문이 보고됨. (H. Nam et al., 2020, Scientific Reports)

4. 오간온어칩(Organ-On-a chip)
기술 설명
‘오간온어칩 (Organ-on-a Chip)’이란, 사람의 장기 또는 조직의 구조와 기능을 체외 환경(in vitro)의 작은 칩 위에서 구현하는 기술로 장기는 특정 기능을 하는 조직들이 모인 복잡다단한 생체 구조로 일종의 하위 레벨로 ‘조직온어칩 (Tissue-on-a Chip)’을 개발하는 기술도 함께 진행되고 있어 오간온어칩과 혼용되는 개념으로 사용되고 있음
오간온어칩 기술은 위에서 언급한 조직 공학의 성공에 있어서 당면했던 도전적 문제점들을 해결하기 위해서 새롭게 뻗어나온 분야라고 할 수 있는데 이는 1998년 미국 Harvard Whitesides 교수 연구팀이 반도체 공정의 일부를 차용하여 투명하고 기체가 투과하는 탄성 고분자인 polydimethylsiloxane (PDMS)에 미세유체 (microfluidic) 채널 등을 집적할 수 있는 미세가공 기술인 soft lithography를 발표하면서 접목되기 시작하였음.
- Soft lithography 기술로 미세유체 칩을 만들고 마이크로채널을 통해 배양액을 흘려주면서 세포 배양을 시작한 것이 오간온어칩의 시초라 할 수 있음.

오간온어칩 기술의 국내외 현황
현재 오간온어칩 기술을 선도하는 국가는 미국으로 2012년부터 미국 정부 차원 다부처 프로젝트인 ‘Tissue Chip for Drug Screening’을 시작하면서 이 분야를 선도하고 있고, 수년 전부터 오간온어칩은 미세생리시스템 (microphysiological systems; MPS)이라는 다른 명칭으로도 불리기 시작함.
현재 오간온어칩 기술을 선도하는 국가는 미국으로 2012년부터 미국 정부 차원 다부처 프로젝트인 ‘Tissue Chip for Drug Screening’을 시작하면서 이 분야를 선도하고 있고, 수년 전부터 오간온어칩은 미세생리시스템 (microphysiological systems; MPS)이라는 다른 명칭으로도 불리기 시작함.

- 미국 NIH 주도로 DARPA, FDA와 다부처 국가 프로젝트로 2012년에 프로그램이 시작되었고 총 3단계 10년 (2+3+5) 계획으로 2018년부터 3단계에 진입함.
특히 주목할 점은 정부 주도하에 프로그램 개시 시점부터 academia, biotechnology 기업, 제약 회사가 3축을 이뤄 역할 분담 및 계획을 수립하면서 서로 피드백을 주고받는 형태를 취하고 있음.

- 2단계 (2016년 10월)에는 1단계 때 개발하는 개별/단일 조직/장기 칩들의 chip-to-chip variation, day-to-day variation, center-to-center variation 등을 객관적으로 테스트할 수 있는 Tissue Chip Testing Center (TCTC) 3개를 선정함.


- 개별/단일 조직/장기 칩들을 서로 연결하는 멀티 조직/장기 칩 단일 세포 리소스를 이용하기 위한 전략으로 iPSC의 도입을 적극 고려하여 적용 중임.
- 2단계까지 개발된 다양한 조직/장기 칩들을 기반으로 2017년부터 3단계로 넘어가면서 2022년까지 질병 (희귀병 위주) 모델 개발, 약물의 유효성 테스트 및 사업화/제품화를 목표로 진행 중임.


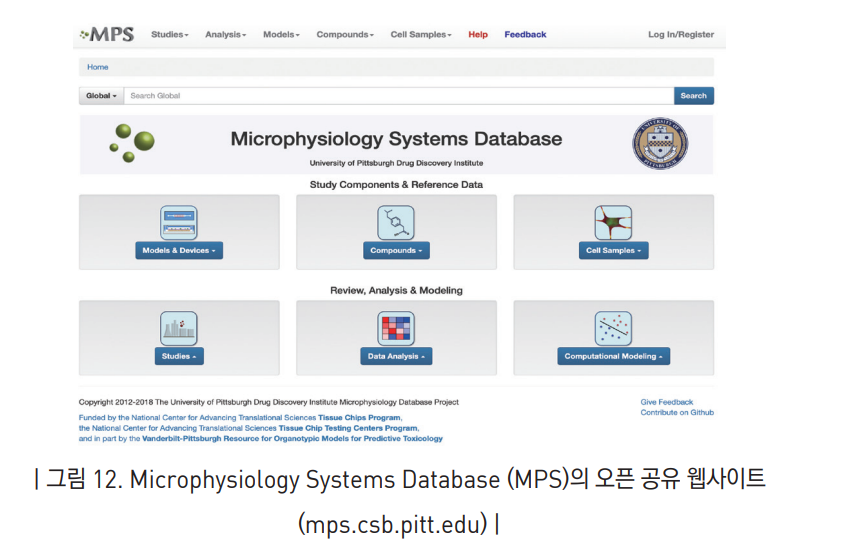
현재 개발 및 검증 중인 조직/장기 칩 모델들은 3개의 Tissue Chip Testing Center들 중 하나인 University of Pittsburgh Microphysiological Systems Testing Database Center에서 데이터베이스를 구축 중이며, 국내에도 비슷한 서비스들이 필요할 것으로 판단됨.
- 모델, 디바이스, 화합물, 세포 샘플, 연구 주제, 데이터 분석, 컴퓨터 모델링까지 망라하여 조직/장기 칩과 관련된 여러 아이템들을 공유하고 있음.
- Tissue Chip Program에 참여하고 있는 기관에서 자체 개발한 디바이스를 사용하고 있는 경우도 있고, 기존의 상용화된 제품 또는 well plate 기반으로 활용 중임.
국내 연구진은 뇌, 피부, 폐 등 다양한 조직을 칩 형태로 제작하는 연구를 수행하고 있으며 기반 기술로는 하이드로젤 패터닝과 다공성 멤브레인을 이용한 다층 구조 형성 방법을 가장 많이 사용하고 있음.
- 보통 2종 이상의 장기칩 제작에 대한 연구를 수행하는 경우가 많으며 활발한 공동연구도 진행되고 있고 최근 제안된 3차원 생체조직 칩 기반 신약개발 플랫폼 기술 개발 사업을 통해 이런 공동 개발과 장기간의 연결이 적극적으로 지원되는 중임.
해외 연구자 또한 하이드로젤 패터닝과 다공성 멤브레인 기반 다층 구조 형성 방법을 사용하고 있어 해외 연구진과 국내 연구진 사이에 기본적인 제작 기술 측면에서는 차이가 없음.
- 그러나 해외 연구진의 경우 환자 세포, 질환 모델 세포 및 환자 혈액 등 수급에 있어 강점을 보이고 있어 오간온어칩을 기반으로 한 질환 연구를 원활히 수행할 수 있는 환경이 제공되고 있는 실정임.



오간온어칩의 국내외 사업화 현황
서울대학교 전누리 교수 연구팀의 기술을 바탕으로 CURIOCHIPS 회사가 2017년에 설립되었음. 모세관 힘으로 3D 액체/젤을 가이드 패터닝하는 것이 핵심 기술이며 웰 플레이트 내 다양한 패턴 또는 multiplicate 배치 가능한 제품들로 CurioSlideTM, CurioPlateTM를 출시하였는데 이 제품들은 혈관 포함 조직, 신경 조직, 뇌 혈관 장벽, 암 조직 및 면역 항암 분야에 활용이 가능함.
홍익대학교 성종환 교수 연구팀의 기술을 이전 받아 제품 개발 중인 ㈜다인바이오 는 장-간 칩과 피부 칩 개발을 위한 핵심 기술 2건을 이전한 후 제품화 중이며 성종환 교수 연구팀의 보유 기술 중 다중 조직/장기 칩 제작 기술은 해외 기업인 Hesperos와 Emulate에 이전 후 제품 개발이 진행 중임.
고려대학교 고 이상훈 교수 연구팀의 기술을 바탕으로 한 MICROFIT은 피부 칩과 3D 오가노이드/스페로이드 배양 플레이트를 제품화함.
고려대학교 정석 교수와 미국 MIT Roger Kamm 교수의 연구팀의 기술을 바탕으로 공동 설립한 AIM BIOTECH는 싱가포르에 위치한 회사로서 미세유체 채널 내 공기-액체 계면을 활용한 젤 주입으로 혈관 및 암의 3D 세포 주위 미세 환경 (전이 모델 포함) 구현 가능하고 플라스틱 기반 칩 어레이 형태로 제품을 출시하고 있음.

2018년 기준으로 해외에 오간온어칩 제품을 출시 중인 회사들은 미국 12개, 유럽 (스위스, 네덜란드, 독일, 영국) 6개, 싱가포르 1개이며 폐, 간, 신경, 장, 신장, 혈관 등 다양한 조직/장기의 단일 오간온어칩 또는 멀티 오간온어칩을 개발 및 판매 중임.

5. 멀티 오간온어칩
멀티 오간온어칩 기술의 개요
신약개발과정과 질병 연구에 일반적으로 이용되는 기존의 2차원 세포배양 모델의 경우 한 종류의 세포만 배양이 가능하기 때문에 장기와 장기 사이에 일어나는 상호작용이나 연속적인 물질 이동과 반응을 구현할 수 없다는 단점이 있음.
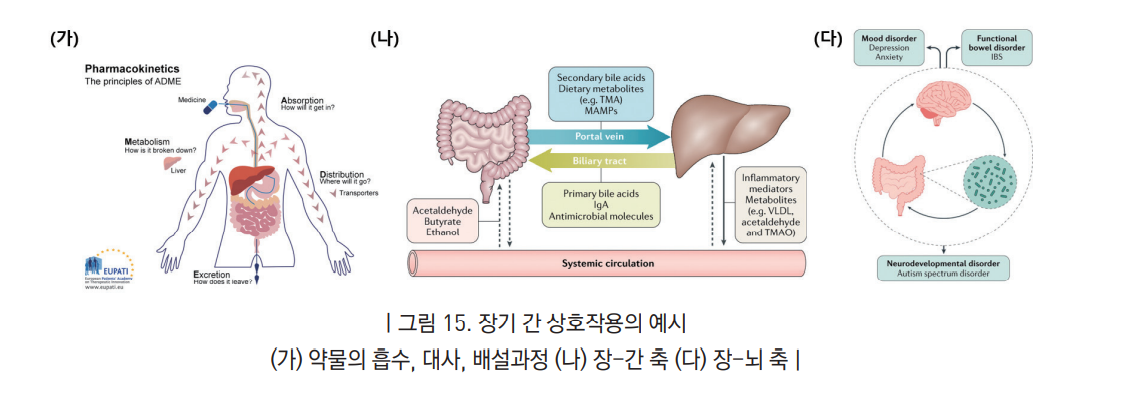
- 예를 들어 인체에서 독성을 보이는 약물이라도 간에서 해독작용을 거쳐 독성이 약화되는 경우가 있고 반대로 직접적으로는 무해하더라도 간 대사를 거쳐 생긴 대사물질이 독성을 보이는 경우가 있음.
- 약물이 체내에서 보이는 효능과 독성은 해당물질의 시간에 따른 농도에 의해 결정됨. 즉 동일한 물질이라도 농도가 지나치게 높으면 독성을 보이고 적절한 농도에서는 효능이 있지만 농도가 너무 낮으면 아무런 효능이나 독성을 보이지 않을 수 있음. 약물의 시간에 따른 농도는 장과 간, 신장, 기타 장기기관들이 종합적이고 동시적으로 작용해서 나타나는 결과임.
- 최근의 임상 및 동물실험을 통해 장기 간 상호작용이 인체의 기능과 질병의 진행에 중요한 역할을 하는 것으로 알려지고 있으나 장-뇌축 (gut-brain axis), 장-간축 (gut-liver axis) 등의 이름으로 불리우는 이 개념은 장기와 장기 사이의 전기, 화학적인 신호전달을 통해 서로 영향을 주고 받고 이러한 상호작용이 잘못될 경우 질병으로 진행될 수 있음을 시사함. (Tripathi, 2018, Nature Reviews Gastroenterology & Hepatology, Dinan, 2017, Nature Reviews Gastroenterology & Hepatology)
1990년대 중반 이러한 세포배양 모델의 단점을 극복하기 위해 서로 다른 장기 유래 세포를 분리된 배양접시 또는 용기에서 배양하면서 튜브와 펌프를 이용해 연결하려는 시도가 있었지만 이를 구현하기 위한 장비나 시스템의 구성이 지나치게 복잡하기 때문에 후속 연구나 제품개발로 이어지지 못했음.
- 1996년 코넬 대학교의 Shuler 교수 연구진은 유리병에 배양된 폐와 간 세포를 튜브와 펌프로 연결하고 폐로 흡인된 나프탈렌이 간에서 대사과정을 거쳐 생성된 대사물이 독성을 보이는 기전을 연구하였음. (Shuler, 1996, Biotech Bioeng)

2000년대 초반 미세유체기술(microfluidics)이 여러 분야에 활용되기 시작하면서 세포배양기술과 결합하려는 시도가 이루어졌고 셀 온어 칩 또는 장기온어 칩 기술의 개념이 생겨남. 미세유체기술을 활용하여 다른 장기 유래 세포를 연결하고 상호작용을 구현하려는 시도가 이루어지기 시작함.
- 2004년 혈관구조를 모사한 마이크로 채널로 폐세포와 간세포를 연결하여 배양한 후, 나프탈렌의 독성 기전을 연구한 논문을 발표. (Viravaidya, 2004, Biotech Prog)
- 2008년 간세포, 항암제 저항성 암세포, 비저항성 암세포, 골수세포를 마이크로채널로 연결하여 배양하면서 항암제에 대한 저항성을 연구한 논문을 발표. (Tatosian, 2008, Biotech Bioeng)
- 이를 기반으로 200년대 중반 최초의 제품화가 이루어짐. (Hurel. 상업화 현황 참고)
멀티 오간온어칩 기술의 현황
2000년대 중반 이후 개별 장기를 대상으로 한 오간온어칩 기술이 발전하면서 개별장기의 구조와 기능을 구현하는 것이 보다 현실적으로 가능해지게 되었고 이러한 성과를 기반으로 2010년대 이후 멀티 오간온어 칩을 구현하려는 시도가 국내와 해외 연구기관을 중심으로 활발하게 이루어지고 있음.
- 2013년 독일 Technische Universitat Berlin의 Marx 연구팀이 간, 피부, 혈관 등을 연결한 멀티 오간온어칩을 발표함. (Wagner, 2014, Lab Chip)
- 2015년 미국 MIT의 Griffith 연구팀에서 장, 간, 신장 등을 연결하고 약물의 약동학 특성을 재현하려는 시도가 발표되었지만 칩의 크기와 구동시스템이 복잡하고 개별 장기의 생리적인 기능들이 완전히 구현되지는 않았음. (Cilfone, 2015, CPT Pharmacometrics Syst. Pharmacol)
- 2017년 한국 홍익대 성종환 교수 연구팀에서 장-간을 연결하여 약물의 장흡수, 간대사와 약동학 특성을 구현한 결과를 발표함. (Lee, 2017, Biomed Microdev)
- 2020년 미국 하버드의 Ingber 연구팀이 장, 간, 신장 세포를 별도배양하면서 배지공급망을 연결하여 약물의 약동학 특성을 구현하려는 시도를 함. (Herland, 2020, Nature Biomed Eng) 하지만 본 시도는 한 개의 통합된 시스템이 아니라 개별 장기온어칩 시스템을 외부적으로 연결한 것일 뿐이라 시스템의 활용이나 제품화에 한계가 있음.

멀티 오간온어칩의 제품화 현황
- Organ on a chip 시장은 2023년 기준 총 $170.33MN 규모의 시장이 될 것으로 예측되며 연평균 매출액 증가율 (CAGR)은 Heart-on-chip에서 가장 크다고 예측되나 모든 장기가 비슷한 수준으로 시장이 성장하고 있으며 시장의 크기는 가장 먼저 organ on a chip이 만들어진 lung-on-chip이 차지할 것으로 예측되고 있음. 멀티 오간온어칩은 제품화가 진행된지 5년 미만이라 아직 별도의 시장규모를 파악하기 어려운 상황임.
- 오간온어칩을 판매하고 있는 기업과 제품에 대해 분류해 보면, 미국의 Emulate와 Hµrel, 독일의 TissUse, 네덜란드의 Mimetas가 대표적인 스타트업 기업임. 아직까지도 스타트업 기업이 가장 많은 시장 점유율을 차지하고 있으며, 2013년 이후 증가하고 있는 특허와 논문 발표를 통해 새로운 장기칩 기반 기술이 보고되고 신생기업들이 나타나는 중임.

- 2010년대 중반 이후 오간온어칩 기술이 확립되고 제품화가 진행되면서 기존의 오간온어칩 제품에서 좀 더 복잡한 구조와 기능을 요구하는 멀티 오간온어칩을 제품 또는 스크리닝 서비스 형태로 출시하는 업체들이 생기는 중임.


6. 결론 및 제언
공학적 다중세포 생물시스템 관련 분야의 국내 연구 및 산업화 수준은 세계적 수준에 결코 뒤떨어지지 않고 있으며, 특히 최근 정부의 적극적인 연구개발 투자가 이루어지고 있음. 이 기술은 최근 COVID19 사태 이후 K-Bio의 발전과 SK바이오팜 등의 새로운 신약개발 등, 국내 바이오산업의 성과를 이어나갈 수 있는 중요한 기술임.
이러한 기존 역량을 보다 확충하여 관련 산업을 선도하기 위해서는 각 기술의 고유한 성격을 고려하되 통합적인 연구개발이 가능한 정부와 민간의 적극적인 연구개발 투자와 산업화 투자가 시급하며, 무엇보다도 대상 장기 및 질병의 특성과 산업성, 시장 규모를 종합적으로 고려한 지원 로드맵의 구축이 절실함.
- 그림 18에는 스페로이드/오가노이드와 조직칩에 기반한 질병 및 장기 모델과 오가노이드와 바이오프린팅에 기반한 조직공학 및 바이오프린팅 제품들이 각 장기 별로 언제쯤 상용화될 것인지에 대한 종합적인 예측을 제시하였는데 질병 및 장기 모델의 상용화는 상당히 빠른 시기에 달성될 것으로 보이며 가장 어려운 멀티오간칩 등도 10년 내에 실제 활용되는 제품을 사용할 수 있을 것으로 예측됨.
- 하지만 조직공학 및 바이오프린팅 장기의 경우 대상 장기마다 난이도가 달라 심장이나 폐와 같은 장기들의 대체는 매우 오랜 시간이 지난 후에 가능할 것으로 보이고 연결된 장기나 뇌와 같은 장기는 아직도 상용화의 길이 보이지 않음. 이에 반해, 뼈나 관절과 같은 임플란트 장기들은 이미 상용화가 된 경우도 많으며 근육, 신장, 장, 췌장과 같은 부드러운 장기들도 임플란트의 형태로 2035년 내에는 상용화를 기대하고 있음. 이번에 소프트임플란트라는 주제로 공모한 알키미스트 사업 역시 이러한 로드맵 하에서 현실적이면서도 가능한 상용화 목표를 가지고 사업을 진행하게 될 것으로 기대됨.

참조 : keit pd 이슈리포트
댓글